真题中的简答题
根据玻璃的形成条件,对SiO2、K2O SiO2、 K2O2 SiO2三种物质形成玻璃的难易程度、热膨胀系数、电导率和熔融温度的大小进行排序,并说明理由。
①形成玻璃由易到难SiO2,K2O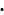 SiO2,K2O
SiO2,K2O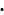 2SiO2
2SiO2
因为一价碱金属氧化物中正离子离子小半径大,为系统提供自由氧使Si/O下降,导致原来硅氧负离子因解聚成较简单的结构单元,而使粘滞活化能降低,粘度变小,冷却过程中越易调整成规则的晶体,形成玻璃越难,所以金属氧化物含量越高越不易形成玻璃
.试简要说明原始粉料的粒度、物料活性、添加物、气氛、压力等因素对烧结的影响规律
a,减小颗粒度,则总表面能增加,因而会有效加速烧结,对扩散蒸发-冷凝机理更为突出
b,烧结是基于表面张力作用下物质迁移而实现的,高温氧化物较难烧结重要原因之一就在于它们有较大的晶格能和较稳定的结构状态,迁移需要较高的活化能即活性较高,因而提高物料活性能促进烧结。
c,当添加物能与烧结体形成固溶体时,将使晶格畸变而得到活化,故可降低烧结温度,使烧结和扩散速度增加。
d,气氛中气体原子尺寸越小扩散系数越大易烧结反之亦然,凡是正离子扩散起控制作用的烧结过程,氧气氛,氧分压较高是有利的,对于易变价金属氧化物,则还原气氛可以使它们部分被还原成氧缺位型非化学计量化合物,也会因O2-离子缺位增多而加速烧结。
e,生环成型压力增大,胚体中颗粒堆积就较紧密,接触面积增大,烧结被加速。
已知Al2O3和SiO2粉末形成莫来石反应由扩散控制,实验在恒定温度下进行,当反应进行1小时的时候,测知已有15%的反应物起了反应。(1)分别用杨德方程、金斯特林格方程计算完全反应的时间。(2)试判断哪个结果更接近实际情况?为什么?(3)若要加速莫来石的生产可以采取什么有利措施?至少举出一种措施
(1)用杨德方程求解
(2)金斯格林格林方程计算结构更接近实际,因为杨德方程假设反应过程中,扩散界面不变,而金斯特格林方程考虑了反应过程中扩散界面的变化,随着反应的进行,反应物体积减小,扩散截面积减小,反应所需时间少于杨德方程计算的结果。
(3)使物料均匀减小,物料颗粒度减小,比表面能越大,反应界面和扩散界面增加,反应物层厚度减小增大压力有助于增大颗粒的接触面积,加速物质的传递过程,使反应速度增加,适当提高反应温度,质点热运动增加,反应能力和扩散能力增加反应速度增加。
高分子链结构分为近程结构和远程结构,他们各自包含哪些内容?
1:,高分子链的近程结构:依据结构单元化学组成不同,高分子链有碳链高分子,杂链高分子,元素有机高分子,无机高分子等类型。远程结构是指单个高分子的结构,包括高分子的大小和形态,决定高分子的柔顺性。
纯金属凝固时,均态核化和非均态核化的形核功大小是否一致?一般情况下两者哪个大?为什么?(5分)
不一致,非均态核化的形核功小,大多数相变是非均态核化在异界面上,这种表面可以通过表面能地作用使核化势垒减少而促进核化进行。
3.为什么在成核-生长机理相变中,要有一点过冷或过热才能发生相变?什么情况下需要过冷,什么情况下需要过热?(5分)
相变要自发进行必须 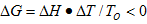
当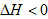 时,为使
时,为使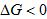 ,必须
,必须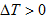 由此可知
由此可知 即在相变过程放热的情况下,系统必须“过冷”才能使相变得以进行
即在相变过程放热的情况下,系统必须“过冷”才能使相变得以进行
当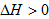 时,
时,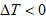 ,
,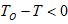 ,系统必须“过热”
,系统必须“过热”
4.简述杨德方程的优点和局限性
适用于稳态扩散,杨德方程在反应初期具有很好的适应性,其在计算产物质时考虑了接触界面的变化,但在产物产物层厚度x带入抛物线方程式又保留了扩散面积恒定的假设。
根据金红石(TiO2)晶胞图回答下列问题(30分)
1.结构中何种离子作密堆积,何种离子填空隙,空隙利用率是多少?写出正、负离子的配位多面体。(8分)O2-作变形六方最紧密堆积;Ti4+填充空隙;空隙利用率1/2;[TiO6] [OTi3]
2.晶胞分子数是多少?Z=2(2分)
3.在什么样的气氛下烧结,才能获得TiO2-x,写出反应方程式;TiO2-x是半导体,实际生产中如何控制其电导率,为什么?(10分)
还原气氛中可获得TiO2-x
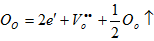
 晶体中氧离子浓度基本不变,而过剩电子的浓度氧空位的两倍,简化为
晶体中氧离子浓度基本不变,而过剩电子的浓度氧空位的两倍,简化为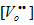 正比于
正比于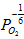 ,所以TiO2的非化学计量导体的电导率随氧分压升高二降低,通过氧分压就可以控制材料的电导率
,所以TiO2的非化学计量导体的电导率随氧分压升高二降低,通过氧分压就可以控制材料的电导率
4.在Al2O3烧结中,加入少量的TiO2可以明显降低烧结温度,促进烧结,请用缺陷理论分析其原因。(10分)
因为Ti4+离子与Al3+半径相近,能与Al2O3固溶外,还由于Ti4+离子与Al3+电价不同,置换后伴随有正离子空位产生,而且在高温下Ti4+可能转变成半径较大的Ti3+,从而加剧晶格畸变,使活性更加有效的促进烧结。
试述玻璃转变与结构调整速率、冷却速率的相互关系
从熔融态变到玻璃态或相反过程,中间出现的是一个和液态-晶态相变性质完全不同的玻璃转变过程,结构调整能否达到该温度的平衡结构取决于结构的调整速率,熔体粘度
松弛所需时间越短,结构调整速率越快,结构调整速率>冷却速率。熔体能达到平衡结构,结构调整速率<冷却速率,熔体结构来不及调整,则偏离平衡结构。
对于MgO、Al2O3和Cr2O3,其正、负离子的半径分别为0.47、0.36和0.40,则Al2O3和Cr2O3形成连续固溶体。(8分)
(1)这个结果可能吗,为什么?
可能,首先要确定金属氧化物中,主要是金属离子位置上的置换。原子或离子尺寸的影响,1-r1/r2=10%<15% 电价因素,为了保证形成固溶体的电中性,不等价置换不易形成连续固溶体。晶体结构类型影响,两者晶体结构一致。
试预计,MgO- Cr2O3系统中的固溶度是有限的还是无限的,为什么?
原子或离子尺寸的影响,1-r1/r2=15%,晶体结构类型的影响,两者晶体结构类型不一致。所以看其系统的固溶度是有限的。
已知CaF2的表面能和硬度均大于PbI2,请判断CaF2 、PbI2表面双电层的厚度的大小,为什么会产生上述现象。
因为与Ca2+和F-相比,Pb2+、I-之间有较大的极化性能。能够极化使表面原子重构,降低系统能量,所以PbI2的表面双电层厚度比CaF2大。
分析熔体Na2O2SiO2、Na2OSiO2、2Na2OSiO2的粘度以及表面张力的大小,并比较其形成玻璃的能力
粘度2Na2O·SiO2<Na2O·SiO2<Na2O·2SiO2
碱金属氧化物的阳离子所带电荷少,半径大,为系统提供“自由氧”而使Si/O比值下降,从而使原来的硅氧负离子解聚为较简单的结构单元,使或性能降低,粘度减小。
一般Si/O比值越大,熔体中聚合阴离子团越大,e/r比值越小,相互作用力越小,因此这些聚合阴离子团就部分被排挤到熔体表面,降低表面张力,粘度越小。一价金属阳离子的加入以断网为主,它的加入使聚合阴离子团解聚。使得e/r增大,粘度增大。
所以粘度 2Na2O·SiO2<Na2O·SiO2<Na2O·2SiO2
形成玻璃能力2Na2O·SiO2<Na2O·SiO2<Na2O·2SiO2
一般聚合阴离子团的尺寸越大,这些负离子团位移,转动,重排就越困难,质点在冷却过程中调整成规则排列的晶体就越难,就越易形成玻璃。
BaTiO3和CaTiO3都属于钙钛矿结构,其中BaTiO3晶体具有铁电效应而CaTiO3没有,
从结构方面予以解释;
具有铁电效应的晶体必存在自发极化,该极化源于晶胞内部正负离子电荷中心不重合,两者均为钙铁矿结构,符合ABO3组成形式,当A原子发生变化,如半径增大必使晶胞参数增大,进而使八面体空隙增大,Ca2+半径小,在CaTiO3中八面体空隙小于Ti4+半径,Ti4+受到很强的弹性恢复力而不能固定在某处以产生正负电荷中心的偏离,故无自发极化的产生,而BaTiO3中八面体空隙大于Ti4+半径,使其受到恢复力小,同时由于Ti4+的极化作用与O2-产生电场力,足以使Ti4+产生偏移形成自发极化偶极,又BaTiO3中[TiO6]八面体沿C轴呈直线排列,有利于电畴传递,故BaTiO3有铁电效应。
根据书写过程总结出写组成缺陷反应方程式的一般规
一般规律:(1)高价正离子占据低价正离子位置时,该位置带有正电荷,为了保持电中性会产生间隙负离子或正离子空位。
(2)低价正离子占据高价正离子位置时,该位置该有负电荷,为了保持电中性。会产生负离子空位或者间隙正离子。
说明新相形成初期温度起伏与新相形成的关系
当温度从熔融温度开始降低时,首先会使生长速率有最大值,但此时成核速
率小,不易形成新相,在某一温度时成核速率有最大值,但生长速率较小,
也不易形成新相,因此,两曲线的交界区域,即图中的阴影区域,I U均有较
高的速率,有利于形成新相。
.简述影响扩散的因素
影响扩散的因素
外在因素:
温度: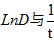 成线性关系
成线性关系
杂质:一方面可能导致扩散介质晶格畸变,另一方面也可能使扩散粒子附加键力,前者使D增大后者使D减小。
气氛:
固溶体类型:间隙固溶体比置换型固溶体易扩散因为间隙型扩散机制的扩散活性能小于置换型扩散
内在因素:
(1)扩散物质性质的影响:扩散粒子性质与扩散介质间差距越大扩散系数也越大。
a,原子键力越强扩散激活能Q值越高,D越小
b,晶体结构的影响,原子排列越紧密,原子间的结合力越强,扩散激活能越高,D越小。
扩散介质结构的影响:通常扩散介质结构越紧密扩散越难,如体心立方结构堆积因子小于面心立方,较疏松,以扩散。
位错、晶界和表面对扩散的影响 D表面>D晶界>D
晶体中的结构缺陷按几何尺寸可分为哪几类?点缺陷,线缺陷,面缺陷;
什么是负扩散?由低浓度向高浓度的扩散;
烧结初期的特征是什么?
坯体间颗粒重排,接触处产生键合,大气孔消失,但固-气总表面积变化不大;
硅酸盐晶体的分类原则是什么?
按硅氧比值分类或按硅氧聚和体的大小分类;
烧结推动力是什么?它可凭哪些方式推动物质的迁移?
表面能的降低,流动传质、扩散传质、气相传质和溶解-沉淀传质
相变的含义是什么?从热力学角度来划分,相变可以分为哪几类?
随自由能的变化而发生的相的结构的变化,一级相变、二级相变和三级相变。
表面力的存在使固体表面处于高能量状态,然而,能量愈高系统愈不稳定,那么固体是通过何种方式降低其过剩的表面能以达到热力学稳定状态的。
一是通过表面质点的极化、变形、重排来降低表面能,二是通过吸附来降低表面能
请分析熔体结构中负离子团的堆积方式、聚合度及对称性等与玻璃形成之关系。
当O/Si由2→4时,熔体中负离子团的堆积形式由三维架状转化为孤立的岛状,负离子团的聚合度相应 的降至最低。一般情况下,熔体中负离子团的聚合度越高,特别是形成三维架状的空间网络时,这些大的聚 合离子团位移、转动、重排都比较困难,故质点不易调整成规则排列的晶体结构,易形成玻璃。熔体中负离 子团的对称性越好,转变成晶体越容易,则形成玻璃愈难,反之亦然。
试从结构和能量的观点解释为什么D晶界>D晶内?
晶界上质点排列结构不同于内部,较晶体内疏松,原子排列混乱,存在着许多空位、位错、键变形等缺 陷,使之处于应力畸变状态,具有较高能量,质点在晶界迁移所需活化能较晶内为小,扩散系数为大。
试分析二次再结晶过程对材料性能有何影响?工艺上如何防止或延缓二次再结晶的发生?
二次再结晶出现后,由于个别晶粒异常长大,使气孔不能排除,坯体不在致 密,加之大晶粒的晶界上有应力存在,使其内部易出现隐裂纹,继续烧结时坯体易膨胀而开裂,使烧结体的机械、电学性能下降。工艺上常采用引入适当的添加剂, 以减缓晶界的移动速度,使气孔及时沿晶界排除,从而防止或延缓二次再结晶的发生。
Na2O-SiO2系统中随SiO2含量的增加,熔体的粘度将粘度增加。
扩散的推动力是浓度梯度,所有扩散系统中,物质扩散也可以从低浓度向高浓度进行
晶粒正常长大he反常长大都是晶界移动的结果。正常长大是晶粒平均尺寸增加,反常长大是个别大晶粒尺寸异常增加
固溶体是在固态条件下,一种物质以原子尺寸溶解在另一种物质中形成的单相均匀的固体。
在热力学平衡条件下,二元凝聚系统最多可以3相平衡共存,它们是两个固相和一个液相
什么叫弛豫表面?NaCl单晶表面具有什么样的结构特点?
表面上的原子产生相对于正常位置的上、下位移,称为表面弛豫。(2分)
NaCl单 晶中处于表面层的负离子只受到上下和内侧正离子的作用,而外侧是不饱和的。电子云将被拉向内侧的正离子一方而变形,使该负离子诱导成偶极子。这样就降低了 晶体表面的负电场。接着,表面层离子开始重排以使之在能量上趋于稳定。为此,表面的负离子被推向外侧,正离子被拉向内侧从而形成了表面双电层。
为什么在成核一生成机理相变中,要有一点过冷或过热才能发生相变?什么情况下需过冷,什么情况下需过热,各举一个例子。
由热力学可知,在等温、等压下有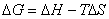
在平衡条件下,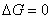 ,则有
,则有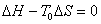
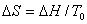
式中:T0是相变的平衡温度;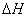 为相变热。
为相变热。
若在任意温度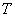 的不平衡条件下,则有
的不平衡条件下,则有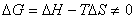
若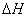 与
与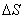 不随温度而变化,将上式代入上式得:
不随温度而变化,将上式代入上式得:
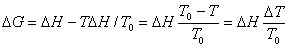
可见,相变过程要自发进行,必须有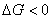 ,则
,则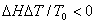 。
。
(1)若相变过程放热(如凝聚、结晶等)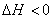 。要使
。要使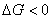 ,必须有
,必须有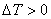 ,
,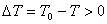 ,即
,即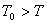 ,这表明系统必须“过冷”。
,这表明系统必须“过冷”。
(2)若相变过程吸热(如蒸发、熔融等)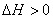 ,要满足
,要满足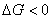 这一条件则必须
这一条件则必须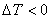 ,即
,即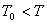 ,这表明系统要自发相变则必须“过热”。
,这表明系统要自发相变则必须“过热”。
粒径为1μ球状Al2O3由过量的MgO微粒包围,观察尖晶石的形成,在恒定温度下,第一个小时有20%的Al2O3起了反应,分别用扬德方程、金斯特林格方程计算完全反应的时间,对计算结果进行比较并说明为什么?
扬德方程[1—(1—G)1/3]2=K4t t=194.6h(2分)
金斯特林格方程1—2/3G—(1-G)2/3=K6t t=68.1t=68.1(2分)
扬德方程假设反应过程中扩散截面不变,而金斯特林格方程考虑了反应中扩散截面的变化。随反应的进行,反应物体积减小,扩散截面变小,所需反应时间要比扬德假设所计算出的时间短。
陶瓷材料中晶粒的大小与什么有关?工艺上如何控制晶粒尺寸(请列出三种途径)
陶瓷材料中晶粒的大小与物料的原始粒度、烧结温度和时间等因素有
控制晶粒尺寸方法:控制原始粒度均匀细小,控制烧结温度和时间,添加剂等。
硅酸盐熔体的结构特征是什么?从Na2O—SiO系统出发,随引入B2O3量的增加,系统的粘度如何变化,为什么?
[SiO4]为基本结构单元,四面体组成形状不规则大小不同的聚合力子团,络阴离子团之间依靠金属离子连接。
从Na2O—SiO2系统出发,随引入B2O3量的增加, [BO3]与游离氧结合,转变为[BO4],使断裂的网络重新连接,系统粘度增加(
继续引入B2O3,B2O3以层状或链状的[BO3]存在,系统的粘度降低(
固体是如何降低系统的表面能的,为什么相同组成的固体的表面能总是高于液体的表面能?
固体表面通过表面质点的极化、变形、重排降低固体的表面能;
液体分子可自由移动,通过形成球形表面来降低表面能;
固体质点不能自由移动,只能通过表面质点的极化、变形、重排降低表面能,因此表面能总是高于同组成的液体的表面能
为什么在成核一生成机理相变中,要有一点过冷或过热才能发生相变? 什么情况下需过冷,什么情况下需过热,试证明之。
由热力学可知,在等温、等压下有 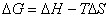
在平衡条件下,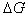 =0,则有
=0,则有 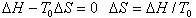
式中: T0是相变的平衡温度; 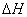 为相变热。
为相变热。
若在任意温度T 的不平衡条件下,则有 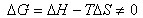
若 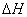 与
与 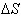 不随温度而变化,将上式代入上式得:
不随温度而变化,将上式代入上式得:
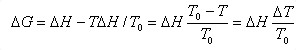
可见,相变过程要自发进行,必须有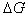 <0,则
<0,则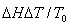 <0 。
<0 。
(3) 若相变过程放热(如凝聚、结晶等)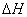 <0。要使
<0。要使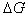 <0,必须有
<0,必须有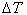 >0,
>0,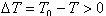 ,即T0>T,这表明系统必须“过冷”。
,即T0>T,这表明系统必须“过冷”。
(4) 若相变过程吸热(如蒸发、熔融等)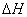 >0,要满足
>0,要满足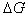 <0这一条件则必须
<0这一条件则必须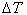 <0,即T0<T,这表明系统要自发相变则必须“过热”。
<0,即T0<T,这表明系统要自发相变则必须“过热”。
如果要合成镁铝尖晶石,可供选择的原料为Mg(OH)2、MgO、γ-Al2O3、α-Al2O3,从提高反应速率的角度出发,选择什么原料较好?请说明原因。(6)
选择Mg(OH)2、γ-Al2O3(3分);因为反应活性高,结构不稳定
下列过程中哪一个能使烧结体强度增大,而不产生坯体宏观上的收缩? (6分)
(a)蒸发冷凝、 (b) 体积扩散、 (c)粘性流动、 (d)表面扩散、(e)溶解沉淀
蒸发冷凝、表面扩散
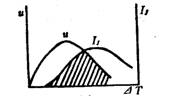
熔体结晶时:(1) 讨论温度对总结晶速率的影响;
(2) 指出在哪一温度范围内对形成玻璃有利,为什么?
1.如右图,I表示核化速率,u表示晶化速率(5分);
2.在阴影部分以外的温度对形成玻璃有利,因为此时核化速率与晶化速率都较小或只存在一种情况(5分)。
从熔体结构角度,估计长石、辉石(MgO·SiO2)、镁橄榄石三种矿物的高温熔体表面张力大小顺序,并分析它们形成玻璃的能力。
长石<辉石(MgO·SiO2)<镁橄榄石(2分)
长石〉辉石(MgO·SiO2)〉镁橄榄石(2分)
| 理由:从长石、辉石(MgO·SiO2)到镁橄榄石,熔体结构从架状、链状到岛状,络阴离子团尺寸减小,作用力矩减小,因此表面张力增大;同理,长石熔体具有架状结构,氧硅比2,网络连接程度好,冷却过程中不易规则排列而容易形成玻璃,镁橄榄石具有岛状,氧硅比4,硅氧四面体孤立存在,冷却过程中易规则排列而最不容易形成玻璃,辉石形成玻璃的能力居中。
氧化铝瓷件表面上涂银后,烧到1000℃时,巳知γ(Al2O3,固)=1J/m2;γ(Ag,液)=0.92J/m2;γ(Ag,液/ Al2O3,固)=1.77 J/m2,试问液态银能否润湿氧化铝瓷件表面?可以用什么方法改善它们之间的润湿性?请提出一种最有可能实现的措施。、
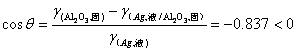 (2分)
(2分)
接解角大于90°,所以液态银不能润温氧化铝瓷件表面(2分)
最有可能实现的措施:在液态银中加入表面活性剂,降低γ(Ag,液/ Al2O3,固),可使其润湿。
根据威尔的表面双电层理论,某些化合物表面可能由负离子组成,正离子被负离子所屏蔽。已知PbI2的表面能为1.3×10-5J/cm2,CaF2的表面能为2.5×10-4J/cm2,请判断PbI2和CaF2的表面双电层厚度的大小,并解释产生的原因。
PbI2> CaF2(2分)。与Ca2+和F-相比,Pb2+与I-具有较大的极化性能,因此表面双电层的厚度较厚
经过计算可知1000℃下氢在面心立方铁中的扩散系数为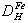 =1.08×10-4cm2/s,同等条件下镍在面心立方铁中的扩散系数为
=1.08×10-4cm2/s,同等条件下镍在面心立方铁中的扩散系数为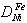 =4.27×10-11cm2/s,
=4.27×10-11cm2/s,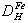 >>
>>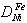 ,请对这种差别进行解释。
,请对这种差别进行解释。
固溶体类型不同,扩散机制不同,导致扩散系数差别很大。1分
氢在面心立方铁中形成间隙固溶体,按间隙扩散机制进行扩散,其扩散活化能比较小,故扩散系数大; 2分
而镍在面心立方铁中形成置换固溶体,按空位扩散机制进行扩散,其扩散活化能比较大,故扩散系数小。2分
或答原子半径小,在相同的扩散基质中进行扩散,阻力小,活化能低,扩散系数大。
实验室要合成镁铝尖晶石,可供选择的原料为MgCO3、MgO、α-Al2O3、γ-Al2O3。从提高反应速率的角度出发,选择什么原料较好?请说明原因。
选择MgCO3、γ-Al2O3较好。 3分
MgCO3在加热到350℃~400℃分解为MgO和CO2,具有比较高的反应活性; 1分
γ-Al2O3在加热到950℃时转变为α-Al2O3,由于发生晶格重排,会使晶格活化,具有比较高的反应活性。 1分
试述熔体粘度对玻璃形成的影响?在硅酸盐熔体中,分析加入—价碱金属氧化物、B2O3后熔体粘度的变化?为什么?(10分)
答:熔体粘度对玻璃形成具有决定性作用。熔体在熔点时具有很大粘度,并且粘度随温度降低而剧烈地升高时,容易形成玻璃。(4分)
在硅酸盐熔体中,加入R2O,随着O/Si比增加,提供游离氧,桥氧数减小,硅氧网络断裂,使熔体粘度显著减小。(3分)
加入B2O3,加入量少时,B2O3处于三度空间连接的[BO4]四面体中,使结构网络聚集紧密,粘度上升。随着B2O3含量增加,B3+开始处于[BO3]三角形中使结构网络疏松,粘度下降。
设体积扩散与晶界扩散活化能间关系为Qgb=Qv/2(Qgb、Qv分别为晶界扩散与体积扩散活化能),根据扩散系数的宏观表达式,画出lnD~l/T曲线,并分析在哪个温度范围内,晶界扩散超过体积扩散?(5分)
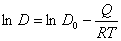 (1分) 以下三种情况,答出一种即可
(1分) 以下三种情况,答出一种即可
1、图2分,说明当1/T〉1/Tc时以晶界扩散为主2分
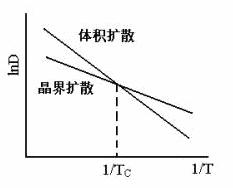
2、图3分,说明在整个温度范围内以晶界扩散为主1分。 3、图3分,说明在整个温度范围内以晶界扩散为主1分

Na2O·2SiO2、Na2O·SiO2和NaCl三种物质,那个最容易形成玻璃?哪个最不容易形成玻璃,为什么?
最容易形成玻璃的是Na2O·2SiO2,最不容易形成玻璃的是NaCl(1分),因为NaCl是例子晶体,离子键化合物形成熔体其结构质点是正、负离子,在熔融状态以单独离子存在,流动性大,粘度很低,在凝固温度靠静电力迅速组成晶格,不易形成玻璃(1分)。硅酸盐熔体形成玻璃倾向的大小和熔体中负离子团的聚合程度有关,聚合程度越低,越不容易形成玻璃,Na2O·2SiO2中O/Si小于Na2O·SiO2,硅氧负离子团大,所以容易形成玻璃。
烧结过程可分为哪几个阶段?其特种如何?烧结的推动力是什么?
烧结分成初期、中期和后期三个阶段(1分);特征(1分):烧结初期胚体中颗粒重排,接触处产生键合,大气孔消失,但总的比表面积变化不大;烧结中期传质开始,粒界增大,空隙进一步缩小变形,单仍然联通呈隧道状;烧结后期传质继续进行,粒子长大,气孔变成孤立闭气孔,制品强度提高,密度大理论密度的95%以上。烧结推动力是系统过剩的表面能(1分)
α-石英转变成α-磷石英(1000℃)的体积效应为16%,而β-石英转变为α-石英(537℃)的体积效应仅为0.82%,而硅砖的烧制和使用过程中在537℃都要对升温速度进行严格控制,为什么?
因为α-石英转变成α-磷石英(1000℃)属于重建性转变,转变速度慢(1分),在实际生产中的正常加热或冷却速度下,体系温度变化速度快于多晶转变速度,因此往往转变不及发生就偏离转变温度,体积效应不明显;而β-石英转变为α-石英(537℃)属于位移性转变,转变速度很快(1分),转变速度快于体系变化速度,因此位移性体积效应非常突出,在升温和降温过程中如果控制不当,往往使制品开裂或影响使用寿命。(
推导出成核生长相变过程中,均态核化临界晶核半径和形成临界晶核时的相变势垒关系式;
当溶液中形成半径为r的球形新相时,整个系统自由含的变化有:
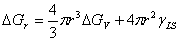 (2分)
(2分)
形成临界晶核时,系统自由焓变化达到最大,因此临界晶核半径由自由焓变化对r微分,并使其等于0来决定,所以有:
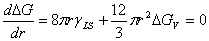 (1分)
(1分)
因此可以解得: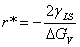 (2分)
(2分)
将临界晶核半径带入自由焓变化式子,可得: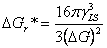 (1分)
(1分)
2、作出过冷度与成核速率的关系图,并说明成核速率与过冷度关系。
均态成核速度和过冷度关系图如下所示:(2分)
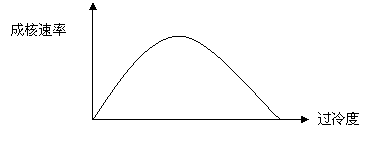 随着过冷度增加,相变的推动力增大,成核速度加快,但经过最大值后继续冷却,核化速率降低,这是由于在过冷度很大时,温度过低,扩散过程非常缓慢,因而使成核速度下降。
随着过冷度增加,相变的推动力增大,成核速度加快,但经过最大值后继续冷却,核化速率降低,这是由于在过冷度很大时,温度过低,扩散过程非常缓慢,因而使成核速度下降。
