一填空题(20分)
1、 在一绝热刚性容器中进行某一化学反应,该体系的焓变化为_
2、 300K时,0.125mol正庚烷(液体)在弹式量热计中完全燃烧,放热602KJ,反应C7H16(l)+11O2(g)=7CO2(g)+8H2O(l)的△rHm=_(RT≈2.5KJ)
3、 10mol単原子分子理想气体的(δH/δT)=_J·K-1
4、 Arrinenius(阿伦尼乌斯)公式适用于_
5、 反应N2(g)+H2(g)=NH3(g)达平衡后加入惰性气体,保持T,P不变,则反应向_进行,Kp_
6、 用同一电导池分别测定浓度为0.01mol·Kg-1和0.1 mol·Kg-1的两个电解质溶液,其电阻分别为1000Ω和500Ω,则它们的摩尔电导率之比为_
7、 在80℃下,将过量的NH4HCO3放入真空密闭容器内,NH4HCO3按下式进行分解:NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g)。在已达平衡的系统中加入CO2,当系统重新达到平衡时,系统的独立组分数C=_,自由度数f=_
8、 设水的化学势为μ*(l),冰的化学势为μ*(s),在101.325Kpa及-5℃条件下,两者的关系为μ*(s)_μ*(l)
9、 1mol单原子理想气体,从p1=202650Pa,T1=273K在p/T=常数的条件下加热,使压力增加到p2=405300Pa,则体系做的体积功W=_
10、当溶液表面活性剂浓度足够大时,溶液便开始形成胶束,胶束的出现标志着_
二选择题(单选或多选)(16分)
1、 在实验室电解水,水分解为氧气和氢气的过程是
(A)自发性不可逆过程(B)自发行可逆过程(C)非自发行可逆过程(D)非自发性不可逆过程
2、1mol理想气体N2(g)的温度为T,若经绝热可逆压缩系统的压力由P增至3P,则下面的关系正确的是
(A)S=0 S环=0 (B)S>0 S环=0 (C)S=0 S环>0 (D)S<0 S环=0
3、 浓度为m的不同价型电解质,设1-3型电解质的离子强度为I1,2-2型电解质的离子强度为I2则
(A)I1<I2 (B)I1=I2 (C)I1=1.5I2 (D)无法比较大小
4、 电解质溶液中的正负离子的迁移数之和
(A) 等于1 (B)大于1 (C)小于1 (D)不确定
5、 相对稳定的溶胶的依数性不显著是因为
(A)粒子体积太大 (B)溶液浓度太大(C)溶液浓度太小(D)质粘度太大
6、 有一露天空气中的圆球形液膜,其直径为d,表面张力为,则该液膜所受的附加压力为
(A)P=4σ/d (B)P=6σ/d (C)P=8σ/d (D)P=2σ/d
7、 在101.325Kpa的大气压力下,将蔗糖在水中的稀溶液缓慢的降温,首先析出的为纯水。相对于纯水而言,加入蔗糖将会出现:沸点
(A)升高(B)降低(C)不变(D)无一定变化规律
8、 r1和r2分别代表同一物质的两种微晶体的半径,c1和c2分别代表其相应的溶解度,若r1>r2,则必有
(A)c1=c2 (B)c1>c2 (C)c1<c2 无法比较
三简答题(25分)
1、298K时,纯水的饱和蒸汽压是3.17Kpa,水溶液中水蒸气的平衡分压是2.733Kpa。若选298K下与0.133Kpa水蒸气达平衡的假想纯水做标准态,溶液中水的活度是多少?
2、1mol、373K、101.325Kpa的H2O(l),向真空蒸发为1mol、373K、101.325Kpa的H2O(g),此过程的△G是否为零?该过程是否可逆?
3、封闭绝热循环过程一定是可逆循环过程吗?说明原因
4、为什么晴朗的天空是蓝色的?
5、过热液体发生爆沸的原因是什么?
6、如果反应的时间足够长,则在标准状况下进行的△rGm<0化学反应都能全部转化生成产物(反应物的物质的量之比为化学反应剂量比)。为什么?
四计算题(70分)
1、 在298K,10dm3、3×100Kpa的氧气,反抗恒外压10Kpa进行绝热不可逆膨胀,求该过程的Q、W、△U、△H、△S、△G、△A并指出判断过程性质所用判据。已知氧气在298K时的摩尔熵为205J·K-1·mol-1。设氧气为理想气体。(18分)
2、 已知电池Pb(s)︱PbSO4(s) ︱H2SO4(0.01mol·Kg-1) ︱H2(g,100Kpa) ︱Pt,25℃时的电动势为0.1705V,有关物质在25℃时的标准摩尔吉布斯自由能函数为△fGm{H2SO4(aq))=742.99KJ·mol-1,△fGm{PbSO4(aq))=811.24KJ·mol-1
(1) 写出电极反应和电池反应
(2) 求25℃时的标准电极电势Φ{SO42-/PbSO4(s)/Pb}
(3) 求25℃时H2SO4在浓度为0.01mol·Kg-1溶液中的α±和γ±
3、25℃时,臭氧分解机理为:O3=O2+O(快) k1 k-1
O+O3—2O2(慢) k2
(1) 请分别导出O3分解和O2生成的速率表达式
(2) 指出两个速率公式k(O3)和k(O2)的关系
(3) 指出该分解反应的级数,若要以mol·dm3,时间以s为单位,指出速率常数单位(15分)
4、313.2K时,如果将1molA(l)和2molB(l)的混合物放在真空容器中。(1)求起始蒸汽相的压力和组成(2)如果此容器有一个可移动的活塞,可让液相在此温度时尽量蒸发,当只剩下最后一滴液体时,求液体的组成和蒸汽压。已知313.2K时,PA*=106.9Kpa,PB*=33.59Kpa(12分)
5、室温下假设树根的毛细管管径为2.00×10-6m,水渗入与根壁夹角30.求其产生的附加压力,并求水棵树送的高度。(设25℃时,水的σ=75.2×10-3N·m-1,ρ=999.7Kg·m-3)(10分)
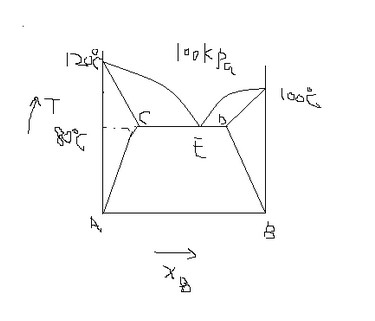
6、A和B在100Kpa的气液平衡相图如图所示。C、E、D三个相点的组成分别为XB.C=0.05 XB.E=0.60 XB.D=0.97(1)计算3molB与7molA的混合物在100Kpa、60℃达平衡时气液各相的量各为多少?(2)假定平衡相点C和D所代表的两个溶液均可视为理想稀溶液,试计算100Kpa、60℃时纯B的饱和蒸汽压及A的亨利常数(组成以摩尔分数表示)。(15分)