一、填空题(每空 2 分、共 24 分)
1 、 1mol 理想气体经节流膨胀(即 Joule-Tomson 实验)压力自P 1 降低到P 2 ,此过程的△A ________0 ,△U ______0 。(填 > , = 或 < )
2 、 298K 时, HCl(g) 的标准摩尔生成焓△ f H m=-92.31kJ/mol ,HCl(g) 的无限稀释摩尔溶解焓(即 1molHCl(g) 溶于水形成无限稀薄溶液时的△ H )为 -75.13kJ/mol 。若以 b= b ( θ ) 但仍遵守亨利定律的溶液作标准态,则 HCl(aq) 的标准摩尔生成焓△ f H m ( HCl,aq ) =_______ 。
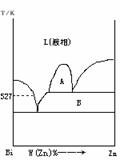
3 、下图为 Bi-Zn 二组分体系的固液平衡相图,
(1) A 区的平衡相态为 ______,
B 区的平衡相态为 ________ 。
(2) 527K 时,纯 Bi(s) 和含 93%Bi (质量百分数)的溶液成相平衡。若以纯 Bi(s) 作标准态,则上述溶液中 Bi 的活度为 _________ ,活度系数为 __________ 。( Bi 和 Zn 的相对原子质量分别为 209 和 65.39 )
4 、某原子基态与第一激发态的能级是非简并的,第一激发态的简并度为 3 ,若其他能级可被忽略,且以基态作为能量的零点, 298K 时,此原子的电子配分函数q e=______ 。当体系平衡时,在此二能级上的粒子数之比N 2 /N 1=___________ 。(玻尔兹曼常数 k= 1 . 38×10 -23 J/K)。
5 、对大多数纯物质的液体来说,当温度升高时,其表面张力 __________ 。
6 、实验测得反应 2A+B=C+D 的速率方程式为 r= k 1[A][A][B] ,若反应物的起始浓度为 [ A ]0=2[ B ]0 ,则速率方程式可写为:r=k 2[ A ][ A ][ A ] ,k 1 与k 2 的关系为k 1 = ________ k 2 。
7 、在电池 _____________________________ 中进行的反应是Ni (s) +H 2 O (l) →NiO (s) +H 2(g)
二、选择填空题:(每题 2 分,共 12 分)
1 、若理想气体反应O=∑ν B B在T 1 ~T 2 的温度区间内,各物质均无相变,且△Cp <0 (△Cp=∑ν B Cp ,B ),则在此温度区间内,反应摩尔焓变△rHm随温度升高而( )。
(a)增大 (b)减小 (c)不变 (d)无法确定其变化
2 、某纯物质的液体凝固时,液体的密度大于固体的密度,则该液体的凝固点随压力升高而( )。
(a)升高 (b)降低 (c)不变 (d)不能确定其变化
3 、对于组成不变的均相封闭体系,在w ' = 0 的条件下,=( )
(a) (b) (c) (d)
4 、在浓差电池中,电池的电动势是E,液接电动势是Ej,则( )
(a)E > 0 , Ej > 0 (b)E > 0 , Ej < 0
(c)E < 0 , Ej > 0 (d)E < 0 , Ej < 0
5 、平行反应中,k 1 = 10/min ,k 2 = 20/min ,在反应过程中产物B和C的浓度之比,[B] / [C]=( )
(a)1 (b)2 (c)0 . 5 (d)无法确定其变化
6 、当反应CaCO 3(s) =CaO (S) +CO 2(g) 在某给定条件下达到平衡时,若保持其他反应条件不变,而将CaCO 3(s) 的颗粒变小,平衡将( )。
(a)向左移动 (b)向右移动 (c)不移动
(d)不能确定其移动方向
三、计算题:
1 、在熔点附近的温度范围内,TaBr 5 固体的蒸气压与温度的关系为: lg(p/kPa)=1.696-5650/T;
液体的蒸气压与温度的关系为: lg(p/kPa)=7.296-3265/T 。
试求TaBr 5 三相点时的摩尔蒸发焓及摩尔熔化焓。( 12 分)
2 、在 1000 ℃时,将 4.4 克CO 2(g) 充入一放有过量碳的容积为 1 立方厘米体积的容器中,发生下述反应,CO 2(g) +C (s) = 2 CO (g)
当反应达平衡时,混合气体的平均摩尔质量为 36g/mol 。
(1) 计算此反应在 1000 ℃时的K及容器中的平衡压力。
(2) 当反应达平衡时,充入一些He (g) ,使反应压力增加一倍,求当反应重新达平衡时CO (g) 的质量。
(3) 如果当反应温度升高 10 ℃时,K的值增加一倍,求此反应的△Hm和△Sm(假设△Cp=0)。( 14 分)
3 、电池
(1) 写出此电池的电极与电池反应;
(2) 已知 298 K时,PbSO 4 的容度积Kφ= 1.67×10e-8 ,
(3) 当此电池在端电压为 1 V的情况下,不可逆放电 96500 C时,电池反应热为 -151.61kJ ,计算电池中硫酸根离子的活度a 1 。已知(эE/эT)p=- 4.9×10e-4 V / K。( 14 分)
4 、当一气相反应 2 A──→P在一密闭容器中进行时,实验测得反应器内气体的总压随时间的变化如下:
t/s 0 100 200 300 400
p/kPa 53.5 42.9 38.4 35.7 34.1
( 1 )求此反应的级数和速率系数
( 2 )当反应物消耗掉 60% 时需多少时间?( 14 分)
5 、( 1 ) 20 ℃时将半径为 5×10e-5m 的毛细管插入盛有汞的容器中,在毛细管内的汞面下降高度为 11.10cm 。若汞与毛细管壁的接触角为 140° 。汞的密度为 1.36×10e4 千克每立方米,求汞的表面张力。
( 2 )若 20 ℃时水的表面张力为 0.0728 N / m,汞 - 水的界面张力为 0.375 N / m。试判断水能否在汞的表面铺展开?( 10 分)
