一填空题(20分)
1、 某化学反应在等温等压(298.2K、101.3KPa)下进行,放热40000J,若是反应通过可逆电池完成时,吸热4000J,则系统可能做的最大功为_
2、 下列公式的适用范围为:
(a) S=nRT㏑(p1/p2)-Cp㏑(T2/T1)= nRT㏑(V1/V2)+Cv㏑(T2/T1)_
(b) d㏑p/dT=△vapHm/RT2_
3、 H2(g)和O2(g)在绝热钢瓶中发生反应生成水,则△G=_
4、 对As2S3溶胶,聚沉能力ZnCl2_NaCl
5、 FeCl3和H2O能形成FeCl3·6H2O、2FeCl3·7H2O、2FeCl3·5H2O、FeCl3·2H2O四种水合物,则该系统的独立组分度为_
6、 设某浓度时CuSO4的摩尔电导率为1.4×10-2Ω-1·m2·mol-1,若在该溶液中加入1m3的纯水,这时CuSO4的摩尔电导率将_
7、 沸点升高,说明在溶剂中加入非挥发性溶质后,该溶剂的化学势比未加溶质前_
8、 在298K时,纯液体A的PA=5×104Pa,纯液体B的PB=6×104Pa假设两液体能形成理想液态混合物,当达到气液平衡时,液相中组成xA=0.4,在气相中B的摩尔分数yB则为_
9、 n mol某气体恒容下,由T1加热到T2,其熵变为△S1,相同量的气体在恒压下由由T1加热到T2,其熵变为△S2,则△S1 和△S2的关系为_
二选择题(20分)
1、 关于吸附热下列说法正确的是
(A) 有的吸附过程放热,也有的吸热 (B)覆盖度增大,吸附热下降
(C)在相同条件下,物理吸附热通常大于化学吸附热(D)物理吸附的吸附热与吸附剂无关
2、1个大气压下,C(石墨)+O2(g)=CO2(g)的反应热为△rHm,下列说法错误的是
(A) △rHm就是CO2(g)的生成焓△fHm (B)△rHm是C(石墨)的燃烧焓
(C)△rHm=△rUm (D)△rHm>△rUm
3、25时,0.01mol糖水的渗透压比0.01mol食盐水的渗透压
(A) 大 (B)小
(C)相等 (D)不一定
4、当发生极化作用时,两电极的电极电势将发生如下变化
(A)φ阳变大φ阴变小 (B)φ阳变小φ阴变大
(C)两者都变大 (D)两者都变小
5、四中浓度都是0.01mol·Kg-1的电解质溶液,其中平均活度系数最小的是
(A)NaCl (B)MgCl2 (C)AlCl3 (D)CuSO4
6、在一个连串反应A-B-C中,如果需要的是中间产物B,则为得其最高产率应当
(A)增大反应物A的浓度 (B)增大反应速率
(C)控制适当的反应温度 (D)控制适当的反应时间
7、在一定的温度和压力下,化学反应达到平衡时
(A)各物质的活度均为1 (B)△rGm=0 (C)Qp=Kp (D)△rGm=∑VBμB
8、对理想的水平液面,其值为零的表面物理量是
(A)表面功 (B)比表面吉布斯自由能 (C)正压力 (D)附加压力
9、298K,0.1mol·Kg-1的HCl溶液中,氢电极的可逆电势约为-0.06V,当用铜电极电解此溶液,Cu电极上的电势应
(A)大于-0.06V (B)等于-0.06V (C)小于-0.06V (D)无法确定
10、很多可燃气体在空气中因支链反应发生的爆炸有一定爆炸极限,其上限主要由于
(A)容易发生三分子碰撞而丧失自由基 (B)总是大于反应分子数
(C)总是等于反应分子数 (D)也可能与反应分子数不一致
三、简答题(20分)
1、常温常压下,石墨转化为金刚石的△Gm298>0,故石墨比金刚石更稳定,所以在自然界金刚石不能长期存在,这种说法是否正确?请说明原因?
2、冻梨放入凉水,表面结冰,里边解冻,试用所学知识加以解释。
3、无限稀释时,Kcl、NaCl、HCl三种溶液在相同浓度、相同温度、相同电位梯度下,三种溶液中Cl的运动速度是否相同?三种溶液中Cl的迁移数是否相同?
4、电解质对胶体溶液起什么作用?
四、计算题(90分)
1、容积为20dm3的密闭容器中共有1mol的H2O成气、液两相平衡。已知80℃、100℃下水的饱和蒸汽压为p1=47.343Kpa及p2=101.325Kpa。25水的摩尔蒸发焓△H(298.15)=44.016KJ·mol-1,水和水蒸气在25~100℃间平均摩尔定压热分别为Cp.m(H2O,l)=75.75J·mol-1·K-1,Cp.m(H2O,g)=33.76J·mol-1·K-1。今将系统从80℃的平衡态加热到100℃的平衡态。求过程的 Q ,△U, △H 及△S。(15分)
2、在298K和101.325Kpa压力下,将直径为1.0um的毛细管插入水中,问需要在管内加多大的压力才能防止水面上升?若不加额外压力,让让水面上升,达平衡后管内液面上升多高?一直该温度下水的表面压力为0.072N·m-1,水的密度为1000Kg·m-3,设接触角为0,重力加速度g为9.8m·s-2(10分)
3、在293K,氨水A(NH3与H2O物质的量比1:85)和氨水B(NH3与H2O物质的量比1:21)上面NH3的蒸汽压分别为10.67Kpa和3.60Kpa。
计算(1)从大量A中移出1molNH3到中NH3的△Gm?
(2)若将标准大气压下的1molNH3(g)溶解在大量B中欧能够NH3的△Gm为多少?(13分)
4、双光气分解反应ClCOOCCl3(g)-2COCl2(g)为一级反应。将一定量双光气迅速引入一个280℃的容器751s后测得系统压力为2.710Kpa,经很长时间反应完成后,系统压力为4.008Kpa。305℃时重复试验,经320s系统压力为2.838Kpa,反应完后系统压力为3.554Kpa。求活化能。(12分)
5、已知298K时,电极反应CrSO4(s)+2e--Cr(s)+SO42-的φ=0.4V并知CrSO4(s)的溶度积Ksp=10-6
(1)写出下列电池的电极反应和电池反应
Cr(s) ︱ CrSO4(s)︱H2SO4(0.001mol·kg-1) ︱H2(p)︱Pt
(2)求该电池298K时的电动势E298(忽略)
(3)已知△H=-5KJ·mol-1,求323K时E323
(4)按D-H极限公式计算 再计算E298(15分)
6、在真空容器里放有过量的固态NH4HS,与25℃下分解为NH3(g)和H2S(g)平衡时容器恁地额压力位66.66Kpa。(1)当放入时容器中已有39.99KpaH2S(g),求平衡时容器中的压力(2)容器中原有6.666Kpa的NH3(g),问需加多大压力才能形成NH4HS固体。(12分)
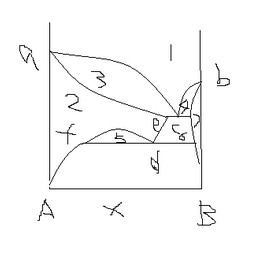
7、二组分金属固液相图如下,请回答下列问题:
(1)注明各区相态
(2)指出相图中哪些点和线的自由度为零。(13分)
图再找找看